Microbiome-Grade DNA提取试剂盒
新的需求已过时的旧方法。
许多出版物报道戏剧性的变化在微生物分析由于使用不同的DNA提取方法[1 - 6]。偏见溶解在DNA提取可能是最大的因素导致这些研究数据重现性差。许多微生物DNA提取方法的分析是在这个领域之前开发的起飞,不幸的是,他们不是为了满足microbiomics的严格要求:无偏和低背景污染。
最常被引用(流行的)方法是过时的。
三个最引用microbiomics出版物中DNA提取方法优先溶解特定类的微生物(图1)。这些包括使用粪便DNA提取协议和推荐的人类微生物组计划(HMP)。这个方法和其他人,当用于宏基因组分析,极大地代表了丰富的easy-to-lyse微生物(例如革兰氏阴性细菌)如图1所示。粪便样本时,这些方法往往代表了大量的拟杆菌、变形菌门和低估了大量的厚壁菌门和放线菌(图2)。这最有可能解释了人类肠道微生物的相互矛盾的解释由高分子聚合物和MetaHIT中描述前一篇文章。
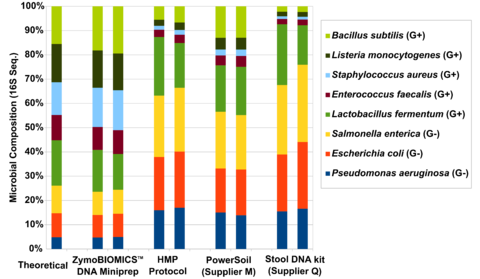
图1所示。评估性能的四种不同的DNA提取试剂盒ZymoBIOMICS™微生物群落的标准。调查包括四个不同的DNA提取方法ZymoBIOMICS™DNA Miniprep工具包人类微生物组项目粪便DNA提取协议(HMP协议),土壤从“M”供应商和DNA提取工具从供应商问:粪便DNA提取工具中提取DNA受到16 s测序与内部图书馆准备协议。微生物组成是由映射对参考原始测序读16 s菌株的序列中包含的标准。
为什么HMP粪便DNA提取协议有偏见?
HMP协议溶解微生物热(95°C孵化)、化学(SDS裂解缓冲),机械与0.7毫米石榴石珠子(涡流)。不幸的是,使用多细胞溶菌作用机制并不一定导致少偏见。热化学方法非常有效地破坏easy-to-lyse,革兰氏阴性细菌(如拟杆菌门和变形菌门),但不强硬的革兰氏阳性微生物(如酵母和孢子)。虽然机械溶菌作用通常被认为是减少偏见的由于它的随机特性,我们发现的规模和密度珠珠中发挥关键作用驱动的溶解。发现在高熔点协议的情况下是0.7毫米石榴石珠子太大,有效溶解小细菌,因此媒体“tough-to-lyse”人口(例如厚壁菌门)。进一步加剧了问题,热化学方法有效地溶解革兰氏阴性细菌,提高人口在最后概要,放大的偏见。
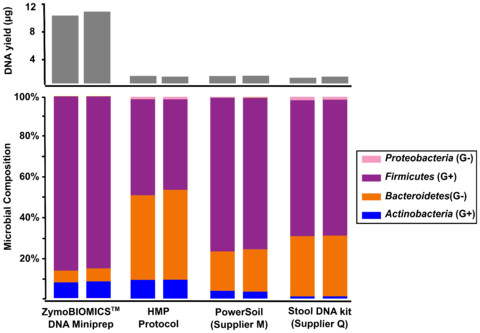
图2。比较四种不同的DNA提取试剂盒和粪便样本。调查包括四个不同的DNA提取方法ZymoBIOMICS™DNA Miniprep工具包人类微生物组项目粪便DNA提取协议(HMP协议),土壤DNA提取工具从“M”供应商和粪便DNA提取工具从“供应商问。“提取DNA受到16 s测序与内部图书馆准备协议。微生物组成决心使用Qiime 1.9.1。
为微生物组测量提取工具设计和验证。
第一步在设计微生物的提取设备测量基准的性能技术对一个已知的输入(如微生物社区标准)。多元化的全细胞标准,Zymo研究能够开发一种技术,实现完整的一系列生物溶解由不同大小和细胞壁的抵触情绪。我们发现一个珠类型无法实现完整的统计(或接近)溶菌作用的微生物测试。相反,我们发现一个公式0.1毫米和0.5毫米的超高密度珠子和一个独特的裂解缓冲确保完整的微生物细胞破坏不管细胞壁的耐寒性和大小(图1)。增强裂解系统,我们看到相同的粪便样本在一个完全不同的光,在壁厚菌门实际上控制了人口(图2)。它可以推断,这是真正的概要文件(或最接近真相)因为我们有证据表明无偏溶解在微生物标准的三个最常被引用的方法是不溶解的更严格的生物,因此大大超过代表easy-to-lyse生物体(图1),进一步支持了这种假设和事实粪便样品的收益率更高的(图2)反映了更大的溶解能力的生物体(厚壁菌门和放线菌),它代表的是大多数人在粪便样本测试。
尝试免费样品的ZymoBIOMICS DNA Miniprep无偏样品裂解设备:
获得免费样品引用:
1。米切尔KR Takacs-Vesbach CD:社区总DNA保存和提取方法的比较从不同的热环境。2008年《工业微生物学与生物技术,35 (10):1139 - 1147。
2。Vishnivetskaya助教,Layton AC、刘MC Chauhan,程KR,迈耶斯AJ,墨菲JR,罗杰斯啊,Saarunya GS,威廉姆斯DE et al:商业观察DNA提取试剂盒影响冻土中微生物群落组成样本。2014年《微生物生态学,87 (1):217 - 230。
3所示。哈特毫升,迈耶,约翰逊PJ,爱立信交流:从粪便DNA提取方法的比较评价的多个主机物种下游下一代测序。《公共科学图书馆•综合》2015年,10 (11):e0143334。
4所示。肯尼迪NA,沃克啊,贝瑞SH,邓肯•SH Farquarson调频,路易P,汤姆森JM Satsangi J,弗林特HJ, Parkhill J et al:不同DNA提取试剂盒和实验室的影响在人类肠道微生物群组成的评估16 s rRNA基因测序。《公共科学图书馆•综合》2014,9 (2):e88982。
5。Sohrabi M, Nair RG, Samaranayake LP,张L, Zulfiker啊,Ahmetagic A, D,魏MQ:细胞和细菌的DNA提取的产量和质量从人类口腔冲洗样品不定地影响细胞溶菌作用方法。2016年《微生物方法,122:64 - 72。
6。Gerasimidis K, Bertz M,海棠C, Brunner K,布鲁斯,康贝特E, Calus年代,鲁曼N, Ijaz是乌斯:DNA提取方法的影响肠道微生物群的研究应用。BMC研究指出2016年,9:365。


