克服COVID-19检德赢体育平台游戏平台测中的样本采集挑战
2019冠状病毒病大流行已在全球造成超过10万人死亡41它已经给全球的医疗系统和经济带来了巨大压力。我们必须控制这种呼吸道感染的传播,以减少死亡率和对生计的破坏。由于COVID-19的高传播率,控制大流行的最佳方法之一将是积极的全球监测项目。然而,为了限制病毒的传播,满足检测需求,样本的采集、储存和运输将是一个重大挑战。德赢体育平台游戏平台
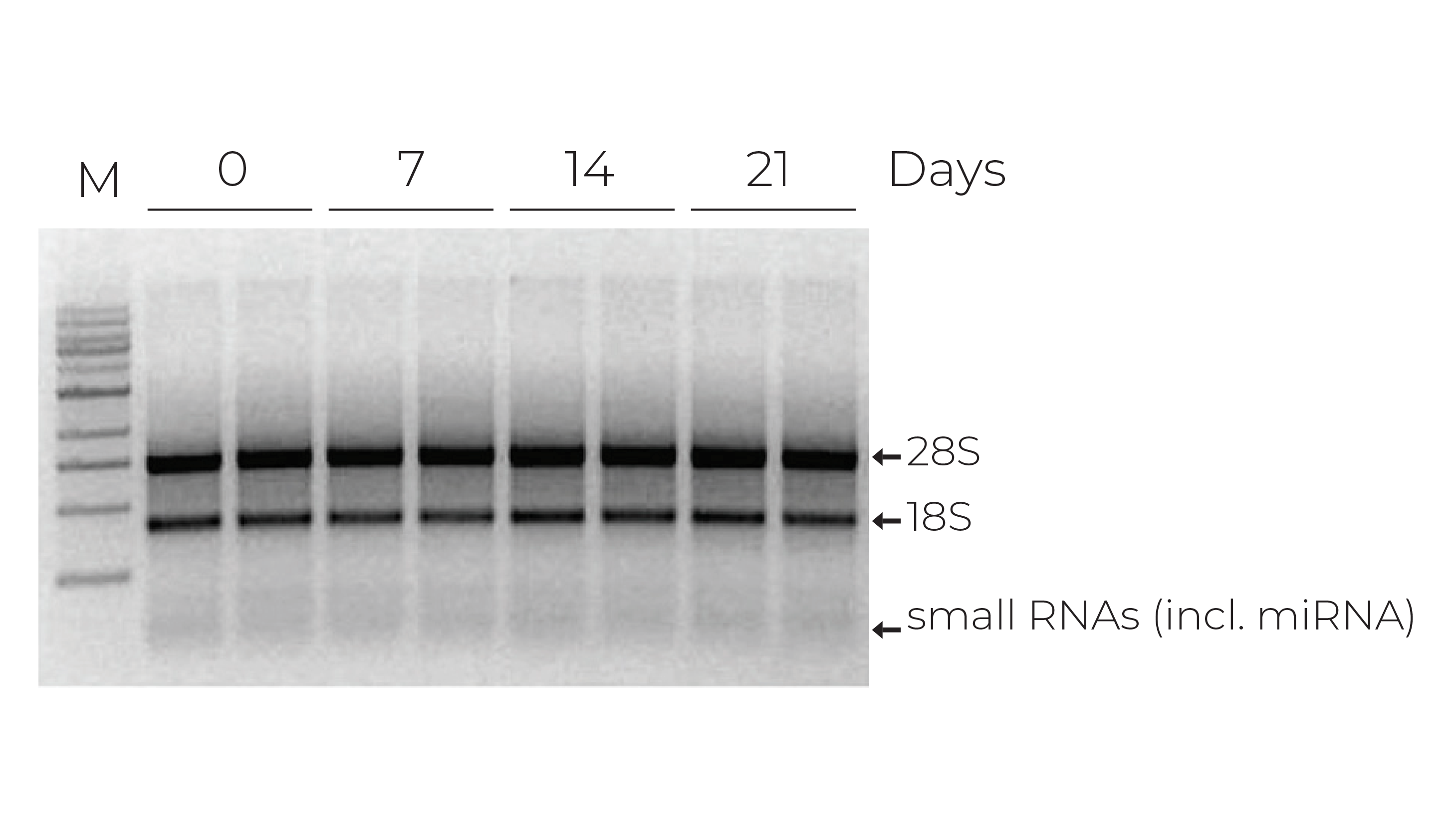
目前的新冠肺炎检测方法主要依靠逆转录定量聚合酶链反应(RT-qPCR)检测病毒RNA。不幸的是,RNA完整性对外界因素非常敏感,如核糖核酸酶、温度、冻融(图1)和ph。由于需要大量的检测,通常收集的样本类型,如鼻咽拭子、口咽拭子和痰,病毒RNA需要在较长时间内保持稳定。此外,一旦收集到样本,由于冷链储存和运输的可用性有限,它们可能会遇到不受控制的环境,因此需要稳定。同样重要的是,快递员、医务人员和检测临床医生接触COVID-19的风险要降到最低,因此收集的样本必须能够安全处理。此外,由于COVID-19检测工作流程在各个诊断实验室之间可能存在很大差异,因此运输介质需要与各种RNA提取方法兼容。
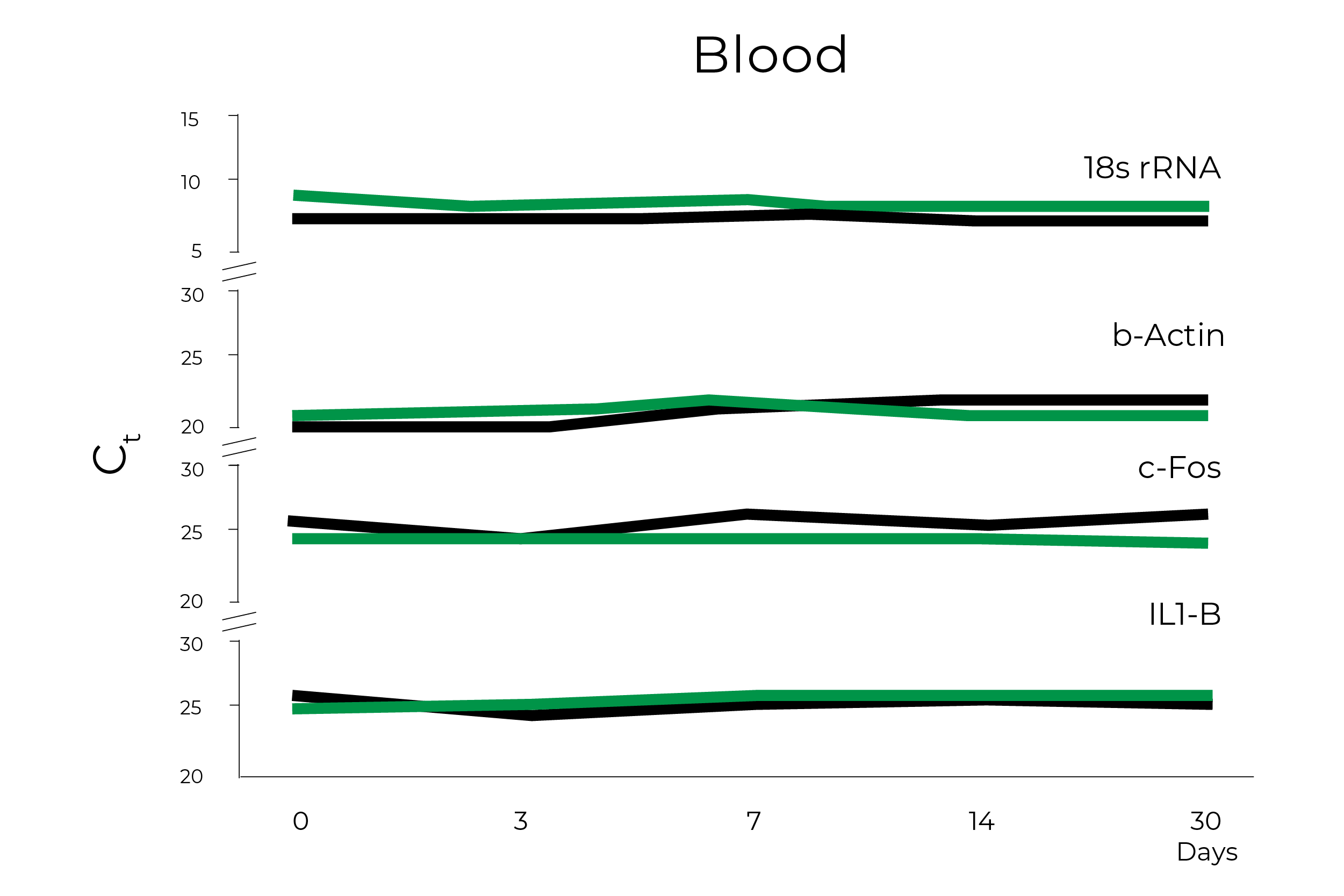
自2006年以来,Zymo Research一直在开发安全运输和存储核酸样本的解决方案,并在这一需要的时候领导了几项工作,为研究人员和组织提供样本收集设备。德赢体育平台游戏平台的DNA / RNA盾德赢体育平台游戏平台样品采集稳定溶液一直是COVID-19检测的重要组成部分,因为它可以轻松克服广泛的COVID-19检测带来的挑战。Zymo Research已经明确证明,储存在DNA/RNA Shield中的全血、唾液、棉签、组织和粪便中的RNA在室温下可稳定达30天(图2)。此外,一项独立研究比较了RNA提取前的各种全血预处理方法,发现在- 80℃存储前,混合了DNA/RNA Shield的全血和外周血细胞的RNA产量、完整性和质量明显更好1.
当涉及到样本稳定性和评估呼吸道病毒感染时,DNA/RNA盾已经广泛地证明了自己。DNA/RNA盾在多项研究中用于收集、运输和保存环境温度下的鼻咽拭子,以调查纽约市的呼吸道病毒感染2,3,4和5.此外,提取的RNA和DNA即使在高于4℃的温度下保存30天,也适用于通过PCR检测病毒2,3,4和5.还在尼日利亚的DNA/RNA Shield中收集了鼻拭子,以成功识别包括冠状病毒在内的呼吸道病毒感染6.此外,还利用DNA/RNA Shield收集鼻拭子,利用RT-qPCR技术调查中东骆驼中中东呼吸综合征冠状病毒(MERS-CoV)的感染情况7,因为它能够灭活病原体,安全的样品运输。除了鼻拭子,DNA/RNA盾还收集了大量其他类型的样本,提取的DNA和RNA超出了通过PCR或次世代测序技术进行病毒检测的范围;这包括结膜拭子7上皮组织8,脑组织9,虾幼虫10,粪便11和12、尿13,蜱虫14细胞系,15,下穹窿拭子16、黄蜂和苍蝇17、头发18,血淋巴19,蚊子20.,口咽拭子21、肝组织22,外周血单个核细胞22和等离子体23日和24日.
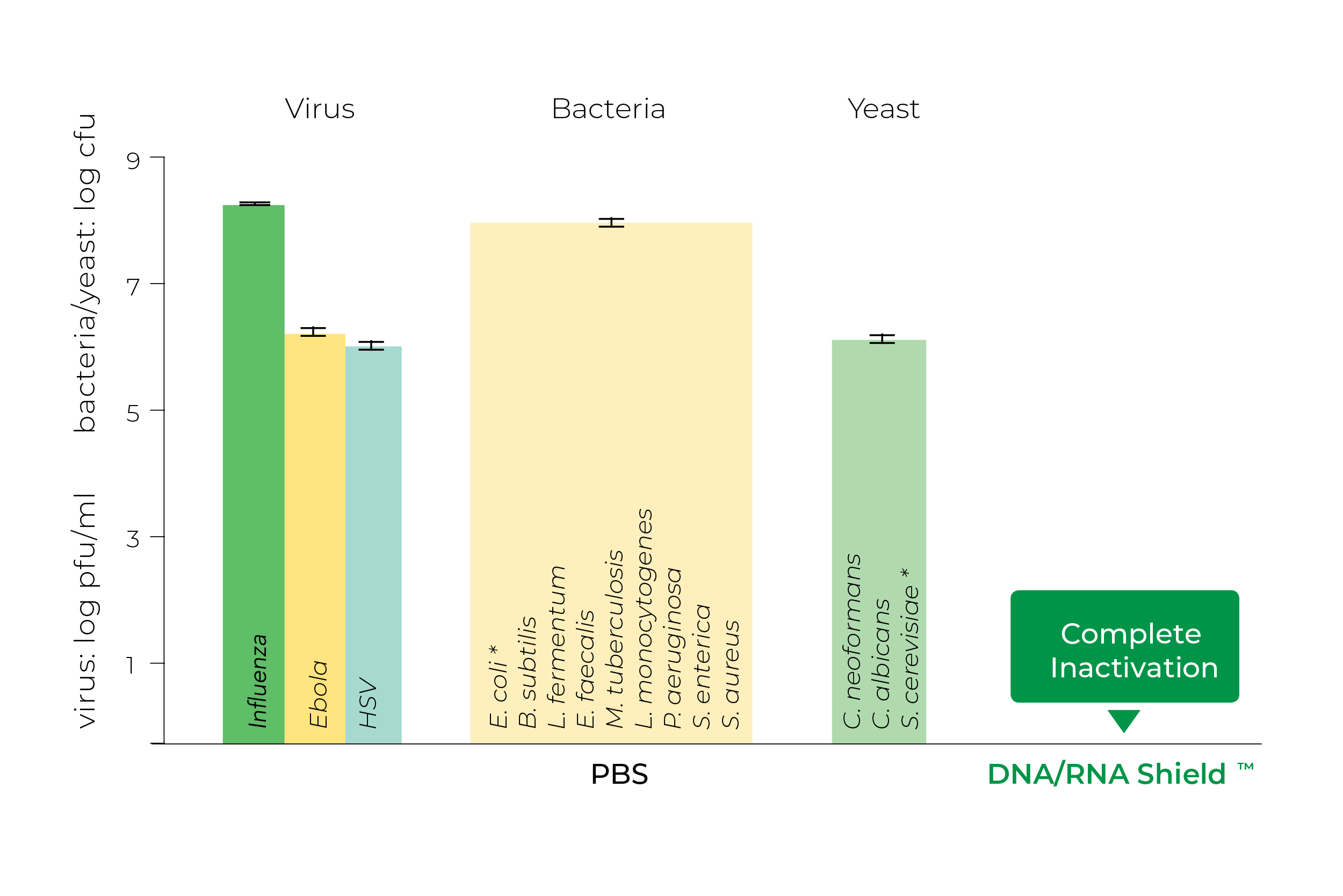
DNA/RNA盾还能够灭活各种微生物和病毒,使其非常适合处理和安全运输生物危险样本。Zymo Research研究表明,许多常见的人类病原体暴露在DNA/RNA盾下5分钟后会完全失活(图3)。
此外,杰奎琳·霍辛顿和同事在2020年的一项研究表明,DNA/RNA盾远远优于RNA晚些时候™灭活口蹄疫病毒8.事实上,一些研究已经使用DNA/RNA屏蔽专门灭活西尼罗河病毒5, 23, 25, 32和MERS-CoV7.
DNA/RNA盾与Zymo研究公司流行的核酸提取试剂盒的兼容性已经在许多研究中得到了独立验证,包括快速-RNA微型准备和微型准备试剂盒7、9、15、19、22、24、26、27、28、29和30,ZymoBIOMICS DNA/RNA迷你试剂盒11 12 31,快速dna / RNA病毒工具包32,Direct-zol RNA迷你试剂盒33和34,快速-RNA全血试剂盒1,快速DNA/RNA病原体小试剂盒20.,快速核糖核酸病毒工具6,快速-DNA/RNA迷你试剂盒14.然而,DNA/RNA Shield也已经与许多其他供应商的核酸纯化产品一起使用,以有效地提取高质量的DNA和RNA,包括来自罗氏的高纯病毒RNA试剂盒德赢vwin体育官方网址10,来自Analytik Jena的innuPREP RNA Mini Kit35,以及Qiagen的QIAamp®DNA的迷你包36, QIAamp®病毒RNA迷你试剂盒23, QIAamp®MinElute病毒旋转套件17.可靠的标准试剂盒®RNA提取已被证明与DNA/RNA屏蔽兼容9, 28和37.
由于需要检测的标本量大,高通量和自动化核酸提取平台也必须与样本采集介质兼容。德赢体育平台游戏平台直接兼容性通过减少步骤数量和时间来减轻初始处理。DNA/RNA盾中的样品可以装入装入自动化平台的板的取样孔中,无需额外的孵育或处理。
Zymo研究公司的ZR-96基因组MagPrep和Qiagen公司的PowerMag®微生物DNA提取试剂盒已成功应用于Tecan FreedomEVO平台上的DNA/RNA盾样品®38.的NucleoMag®来自machery - nagel的VET Kit也从ThermoFisher的翠鸟上的DNA/RNA Shield样本中提取了高质量的病毒RNA™柔性磁粒子处理器8.此外,试剂盒EZ1®病毒小套件v2.0和EZ1®使用先进的XL仪器从DNA/RNA Shield存储的样本中提取RNA,用于基于RT-qPCR的病毒检测13.同样,来自罗氏的MagNa Pure LC仪器和MagNa Pure LC总核酸分离试剂盒也成功地从DNA/RNA盾样品中提取了分子生物学级的病毒RNA18.Biomerieux的NucliSENS®提取套件和NucliSENS easyMAG®该系统已广泛应用于储存在DNA/RNA屏蔽中的鼻咽拭子,用于总核酸提取和病毒检测2, 3, 4,和5.使用Invitrogen公司的iPrep也从DNA/RNA盾样品中提取了高质量的RNA™PureLink™病毒包和iPrep™净化设备21和试剂盒的QIAamp®96 DNA血液试剂盒39.值得注意的是,QIAamp®病毒RNA迷你试剂盒,MagNa PURE LC提取系统,EZ1®高级XL系统和病毒试剂盒,NucliSENS®easyMAG®提取系统,翠鸟™Flex磁颗粒处理器已用于FDA紧急使用授权(EUA)的几个COVID-19分子诊断工作流40.
DNA/RNA Shield能够在环境温度下长时间保存RNA,灭活人类病原体,以及与各种商业化的核酸提取产品的兼容性,使其成为全球COVID-19监测的理想样本收集解决方案。德赢体育平台游戏平台德赢vwin体育官方网址事实上,DNA/RNA Shield由于其优越的存储能力已经被许多政府机构和公司广泛采用,包括国家航空航天局(NASA)德赢体育平台游戏平台、食品和药物管理局、美国农业部、美国国防部、LabCorp和uBiome。
了解更多关于DNA/RNA Shield如何改进COVID-19检测工作流程的信息
参考文献
- 张杰等,“血液RNA提取的三种不同预处理方法的比较”,国际法医科学:遗传学增刊(2019)。
- Galanti, M等人,“无症状呼吸道病毒感染率跨年龄组”流行病学与感染,147(2019)。
- Galanti, M,等,“跨年龄组呼吸道病毒感染的纵向主动采样”流感和其他呼吸道病毒,13(3):226-232(2019)。
- Birger, R,等人,“跨季节流动人群中呼吸道病毒无症状脱落”mSphere, 3(4)(2018)。
- 萨满,J,等。《呼吸道病毒夏季无症状脱落》《传染病杂志》217(7):1074-1077(2018)。
- Kolawole, O,等,“尼日利亚伊洛林社区和诊所呼吸道感染的病因学”,BMC研究,10(1):712(2017)。
- nootny, N, Kolodziejek, J,“单峰骆驼的中东呼吸综合征冠状病毒(MERS-CoV),阿曼,2013年”,《欧洲监测》,19(16)(2014)。
- horrington, J,等,“口蹄疫病毒在低遏制实验室安全运输和处理的上皮样本中的失活”,病毒学方法杂志,276:113770(2020)。
- Brunker, K,等人,“狂犬病消除规划[版本1]”同行评议:等待。
- Pasookhush, P,等,“罗森氏沼虾(巨型淡水对虾)后幼虫对罗森氏沼虾病毒(MrNV)感染的转录组学分析:重新组装和功能注释”,BMC基因组学,20(1):762(2019)。
- 王铮,“母乳和配方奶喂养的晚期早产儿肠道菌群和病毒素的比较”电子学位论文,3375(2019)。https://openprairie.sdstate.edu/etd/3375
- Chard, A,等,“土壤传播的蠕虫病与病毒、细菌和原生动物肠道感染的相关性:老挝农村地区的一项横断面研究”,寄生虫与媒介,12(1):216(2019)。
- Tan, Susanna K.,等。《移植前供体BK Viruriai肾移植受者的影响》,《传染病杂志》,3(2019)。
- Mendell, N,等,“从德克萨斯州沃克县收集的立克次体、Borreliae和Ehrlichiaein蜱的检测,2017-2018年”,昆虫,10(10):315(2019)。
- Jiwaji, Meesbah等人。普罗维登斯病毒:一种在植物中复制的动物病毒,还是一种在动物细胞中感染并复制的植物病毒?科学通报,14(6)(2019)。
- Lalitha, P等人,“结膜炎的无偏病原体检测和宿主基因谱”眼科学(2019年)。
- Bennett, A等人,“果蝠血液中节肢动物起源的各种RNA病毒表明蝙蝠和节肢动物病毒体之间的联系”,病毒学,528:64-72(2019)。
- 斯皮里,A,等,“研究设施中猫的猫杯状病毒场株感染后的环境污染和卫生措施”病毒,11(10):958(2019年),
- Grandjean, F等人,“一种与野生白爪小龙虾大规模死亡相关的新bunya样病毒”,病毒学,533:115-124(2019)。
- Hepp, C等,“亚利桑那州马里科帕县西尼罗病毒的系统发育分析:美国西南部两个主要世系毒株动态行为的证据”,PLoS ONE, 13(11)(2018)。
- Šimić, I,等,“克罗地亚蝙蝠种群中lyssaviruses的分子和血清学调查”,BMC兽医研究,14(1):274(2018)。
- Elmasry, S,等人。“对肝移植后复发感染的直接作用抗病毒药物获得持续病毒学应答的患者中隐匿性丙型肝炎病毒感染的检测”,消化病学,152(3):550-553(2017)。
- “西尼罗病毒阳性献血和后续的人类学调查,奥地利,2014”,公共科学图书馆,10(5)(2015)。
- Phommanivong, V等人,“2013年老挝人民民主共和国南部爆发期间登革热与基孔肯雅病毒的共同传播”热带医学卫生(2016年)。
- Knutie, S和Gotanda, K,“一种收集野生鸟类粪便样本的非侵入性方法,用于微生物组研究”,微生物生态学,76(4):851-855(2018)。
- 石田,等,“肝脏干扰素诱导蛋白与四肽重复调控HCV感染”,干扰素与细胞因子研究,39(3):133-146(2019)。
- Gardner, J, Herbst-Kralovetz, M,“IL-36γ诱导短暂的抗HSV-2环境,保护生殖器疾病和发病机制”细胞因子,111:6371(2018)。
- Elbadry, M,等,“海地6个省农村地区无症状疟疾感染的高流行率:横断面研究”,《疟疾杂志》,2014,14:510(2015)。
- Gardner, J等人,“IL 36γ是阴道微环境中性粒细胞浸润的关键调节剂,并限制生殖器HSV 2感染中的神经侵犯”,《免疫学杂志》(2019)。
- 多恩菲尔德,D,等人。“SMARCA2调节的宿主细胞因子是A型流感病毒MxA限制所必需的。”科学通报,8(1):2092(2018)。
- Stamps, B,等人,“世界上最大的饮用水回用设施的微生物组特征”,微生物学前缘,9:2435(2018)。
- “西尼罗病毒分离株2004Hou3的表型和基因型特征分析”,国际分子科学杂志,20(8):1936(2019)。
- Retallack, H,等,“一种来自Monk Parakeet Myiopsitta monachus的分化型禽偏肺病毒的基因组序列”微生物资源公告,8(16)(2019年。
- Bryant, W,等,“小RNA-Seq分析揭示疟疾媒介冈比亚按蚊跨组织的miRNA表达动态”G3:基因,基因组,遗传学,9(5):1507-1517(2019)。
- Littwitz-Salomon, E,等。“在急性逆转录病毒感染过程中,IL-10+调节性T细胞抑制了自然杀伤细胞的细胞毒性活性”,免疫学前沿,9:1947(2018)。
- Zainabadi, K等,“一种从干燥血点中提取核酸的低密度恶性疟原虫和间日疟原虫超敏检测的新方法”,疟疾杂志,16(1):377(2017)。
- Carrau, L,等人。“变异鲁棒性降低的基孔肯雅病毒候选疫苗在体内减弱,并降低了传播力”,《病毒学杂志》,93(18)(2019)。
- Hugerth, L,等。“人类微生物组采样、16S rRNA基因测序和生物信息学处理的综合自动化管道”,bioRxiv, doi: https://doi.org/10.1101/286526(2018)。
- adam, M,等,“一种超灵敏的反转录聚合酶链反应检测小容量血液样本中无症状低密度恶性疟原虫和间日疟原虫感染”,疟疾杂志,2015年第14期520。
- https://www.fda.gov/medical-devices/emergency-situations-medical-devices/emergency-use-authorizations#coronavirus2019
- https://coronavirus.jhu.edu/map.html


